Assim como qualquer outra doença incurável, o tratamento contra a hipertensão vem acompanhado pelo uso diário de remédios que visam impedir o aumento da pressão arterial. Estes fármacos são classificados de acordo com a seu principal mecanismo de ação.
DIURÉTICOS:
Os diuréticos são fármacos que promovem a excreção renal de sódio, permitindo deste modo a redução da pressão arterial. Este mecanismo se deve a uma mudança na reabsorção de sódio no rim. Além disso, o sódio também contribui para a rigidez dos vasos, o que promove o aumento da pressã dentro do vaso.Os diuréticos são classificados em algumas subclasses:
---->Tiazidas e análogos: atuam na inibição da absorção de sódio pelo túbulo contorcido distal. O transportador de NaCl é bloqueado pelos diuréticos tiazídicos, resultando na diminuição do sódio intracelular, o que aumenta a reabsorção de cálcio.
---->Diuréticos da alça: inibe o sódio-potássio-cloro cotransportador no ramo ascendente da alça de Henle, que normalmente absorve 25% do sódio no sangue. A inibição dessa bomba provoca a hipertonia do túbulo contorcido distal, aumentando a necessidade de água para a sua dissolução.Dessa forma, esse diurético provoca um aumento da perda de água acompanhada de aumento da perda de sódio.

----> Diuréticos poupadores de potássio: inibem a excreção de potássio no túbulo contorcido distal e no ducto coletor.A absorção de Na+ e a secreção de K+ é regulada pela aldosterona, cujo papel é promover a secreção de potássio e a absorção de sódio. A taxa de secreção do íon potássio de correlaciona positivamente com a supressão do íon sódio. A absorção de sódio no ducto coletor gera um potencial elétrico, o que aumenta a secreção de potássio. Os diuréticos poupadores de potássio, que antagonizam os efeitos da aldosterona, interferem nesse processo.Pode ocorrer inibição por antagonismo farmacológico directo dos receptores mineralocorticóides (espironolactona) ou inibição do fluxo de Na+ através dos canais iónicos na membrana do tubo colector (amilorida e triantereno).
----> Inibidores da anidrase carbônica: bloqueiam a reabsorção de bicarbonato de sódio no túbulo proximal.
----> Diuréticos osmóticos: limitam a reabsorção de água principalmente nas regiões mais permeáveis no néfron, como o túbulo proximal e o ramo ascendente da alça de Henle.O aumento concomitante do fluxo de urina diminui o tempo de contacto do líquido com o epitélio tubular, reduzindo, deste modo, a reabsorção de Na+.
BLOQUEADORES-BETA
Relaxam o coração, bloqueando a ação de hormônios como a adrenalina e noradrenalina que fazem o coração bater mais forte.
BLOQUEADORAS-ALFA
Bloqueia os efeitos da adrenalina e noradrenalina nos vasos sanguíneos, relaxando-os e dilatando-os.
VASODILATADORES
Relaxa o músculo liso das artérias, causando a dilatação e diminuição da resistência ao fluxo sanguíneo.
BLOQUEADORES DO CANAL DE CÁLCIO:
Atua bloqueando o fluxo de cálcio nos músculos do coração e nos vasos sanguíneos, causando a dilatação dos vasos.
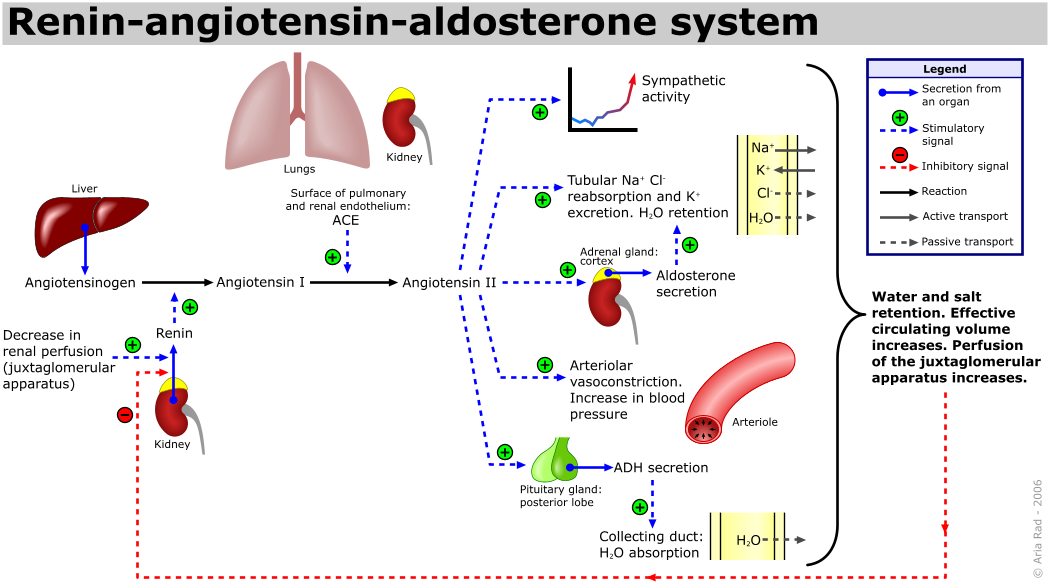
INIBITORES DE ENZIMAS CONVERSORAS DE ANGIOTENSINA:
Bloqueia a ação do hormônio angiotensina (citados em posts anteriores) que diminui o diâmetro dos vasos sanguíneos.
BLOQUEADORES DE RECEPTORES DE ANGIOTENSINA:
--->Dilata as artérias e veias e, assim, reduz a pressão arterial pré-carga e pós-carga e sobre o coração.
--->Abaixa a atividade adrenérgica simpática, bloqueando os efeitos da angiotensina II sobre a liberação do nervo simpático e recaptação de noradrenalina.
--->Promove a excreção renal do sódio e água (natriuréticos e diuréticos) através do bloqueio dos efeitos da angiotensina II no rim.